EU HTA Regulation: relevance, challenges and outlook
German version below

Authors:
Julia Schmidt | Formerly Research Assistant
Laura Suhlrie | Business Development Management
What is HTA and what are its objectives?
HTA stands for “Health Technology Assessment” and is used to systematically and transparently evaluate medical procedures and technologies from different perspectives. It aims to provide evidence-based information for physicians, health authorities, health insurers and patients. Therapeutic and diagnostic procedures as well as more complex health care services such as cancer screening programs can be examined (1). Medical, economic, social, legal, organizational and ethical aspects are intensively discussed with the aim of supporting related decision-making processes and, if necessary, providing recommendations for action (1-4). By presenting all the available external evidence on the issue (e.g. experimental efficacy, effectiveness under everyday conditions, safety, cost-effectiveness etc.) and critically assessing and evaluating it, HTA provides a comprehensive source of information for all stakeholders in the health care system. A distinction must be made between HTA and drug approval. A marketing authorization by the European Medicines Agency (EMA) is crucial for the marketing of the drug in all EU member states and for ensuring the drug’s pharmaceutical quality, safety and efficacy. HTAs target the added benefit for patients in clinical care (5) and serve as a basis and decision support for medical and health policy measures (2).
How do HTAs work at the state level, for example in Germany?
In Germany, there are several organizations that conduct HTAs. A central role in this context plays the Institute for Quality and Efficiency in Health Care (IQWiG), which coordinates questions within the scope of HTAs. These include both non-pharmaceutical and pharmaceutical measures. For example, in the non-pharmaceutical area the IQWIG requested in 2022 HTA reports on participatory decision making and apps for the treatment of an anxiety disorders from external research teams with methodological and clinical expertise (7). In the pharmaceutical field, early benefit assessments as defined by the German Medicines Reorganization Act (AMNOG) are mandatory for newly approved drugs for subsequent price negotiations (1, 2). In contrast to the mandatory AMNOG procedure, IQWIG HTA reports originate in citizen suggestions. These are only forwarded to institutions and stakeholders related to statutory health insurances (SHI), whereas the early benefit assessment has a direct influence on SHI services (3, 5).
Various bodies exist in other European countries that produce HTAs for both pharmaceutical and non-pharmaceutical measures. Examples include (8):
Pharmaceutical:
Non-pharmaceutical:
HTA is becoming European – how come?
With the aim of increasing efficiency, 35 European HTA institutions formed the network EUnetHTA in 2005. From 2010 to 2012, it compiled a database of planned and ongoing HTA projects. Of the 1,266 projects listed, 7% had identical and 16% similar indications. This showed the thematic overlap in HTA projects in different EU countries (9).
Since 2010, EUnetHTA has been preparing so-called “Relative Effectiveness Assessments” (REA) at the European level, which depict the additional benefit in contrast with a comparative therapy. Those provide national health policy makers and national health authorities direction for reimbursement questions. However, there is no obligation to include these project-based HTAs in national decision-making processes such as the AMNOG process. The rapid availability of relevant information through EUnetHTA intends to enable the timely preparation of national HTA reports and subsequent health policy decisions. The background to this is the legal obligation of many EU member states to evaluate new medicines within 90 or 180 days after a positive decision by the Committee for Medicinal Products for Human Use of the European Medicines Agency (EMA). The network developed a “Core Model for Rapid Relative Effectiveness for Pharmaceuticals” as a basic framework for the REAs (see Figure 1). In addition, various guidelines and standardized reporting templates exist to ensure the quality of the REAs (9).
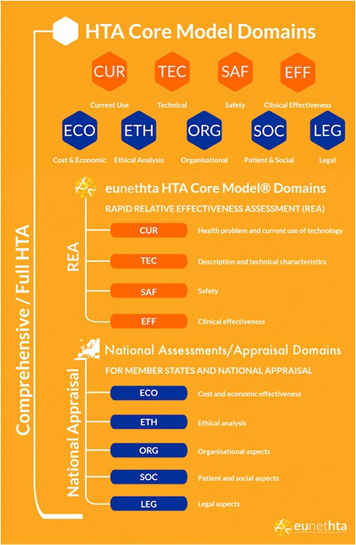
Figure 1: HTA Core Model as methodological framework of the EUnetHTA group for the development and distribution of HTA (10)
What are the objectives of the EU HTA Regulation?
With the EU HTA Regulation, the European Commission pursues to harmonize HTA instruments, procedures, and methods to achieve more effective use of resources and improve HTA quality throughout the EU (11). In the long term, appropriate standards as well as more efficient approaches should accelerate market launches and improve access of new technologies to the healthcare market (12). While the rather project-based REAs were insufficiently used by national institutions and authorities, the HTA Regulation aims for a mandatory joint HTA at the EU level (11).
New EU HTA Regulation – what happens now?
From 2025 onwards, EU member states are obliged to prepare joint HTAs according to the EU HTA Regulation. Different timelines apply to different groups of drugs. For medicinal products with an oncology indication and medicinal products classified as advanced therapies under Regulation (EC) No. 1294/2007, joint European HTAs will be prepared from January 12, 2025. This will be followed by all orphan medicinal products from January 13, 2028, and all other medicinal products as well as class IIb or III medical devices and class D in vitro diagnostic medical devices from January 13, 2030 (6). The EUnetHTA 21 Coordination Group, consisting of 13 EUnetHTA member organizations, will define the methodological basis for the joint assessments over a 24-month period (13, 14).
Decisions on the added benefit of a drug or the reimbursement of interventions remain a national responsibility. This allows country-specific care characteristics as well as financial circumstances of the respective health care systems to be adequately taken into account (13, 15).
Currently, it is planned that EU HTAs will be conducted during the approval process, while German benefit assessments will continue to take place after market entry. For the German health care context, this means that the integration of the EU HTA into the national benefit assessment and decision-making could become the task of The Federal Joint Committee (G-BA) (16).
Can the EMA as a regulatory authority be compared with EU HTAs?
Drug approval by the EMA aims to ensure that only one decision binding for all countries is necessary. EU HTAs don´t intend to produce a decision, but rather to summarize, synthesize, and analyse various pieces of information. Member countries can use HTAs for possible health policy decisions (15).
How can EU HTAs be designed to achieve the goals set?
Whether a mandatory EU-wide expansion of HTAs will lead to the desired resource savings depends on a variety of factors. The goal is to enable joint scientific consultations and clinical assessments. This implies clear and transparent evidence requirements in the therapeutic indications, complemented by a systematic dialogue with all stakeholders and reconciliation of requirements at the regulatory and HTA levels. Especially in clinical situations that do not allow Randomized Controlled Trials (RCTs), it is important to define in advance which methods are acceptable in these cases and which evidence requirements apply to alternative methods. Examples of alternative applications include indirect comparisons, single-arm or crossover study designs, and the use of real-world data. The methods and their acceptability should be consistent, taking into account all the challenges of drug development as well as the medical device market. The time frame of the preparation of the REAs should be clearly defined.
What effects could the EU-wide expansion of HTAs have?
The joint EU approach on HTAs has the potential to save resources, as additional work by different HTA institutions due to addressing identical questions is prevented. Whether the EU-wide HTA will have an impact on standardized evidence requirements for both the regulatory area and HTAs remains questionable. It is desirable that EU HTA institutions streamline and recognize common endpoints. This would facilitate that national HTA institutions wouldn´t need to re-evaluate endpoint assessments. Given that EU-wide recognition of patient-relevant endpoints represents an important argument for the inclusion of an endpoint in approval studies, pharmaceutical manufacturers could also benefit from HTA alignments on European level. Lastly, by formulating EU-wide evidence requirements in clinical research, Europe could foster its negotiating influence in the global pharmaceutical market.
German Version
EU-HTA-Verordnung: Bedeutung, Herausforderungen und Ausblick

Was ist HTA überhaupt und welche Ziele verfolgt es?
HTA steht als Abkürzung für „Health Technology Assessment“ und dient dazu, systematisch und transparent medizinische Verfahren und Technologien aus unterschiedlichen Blickwinkeln zu bewerten um evidenzbasierte Informationen für behandelnde Ärzte, Gesundheitsbehörden, Krankenkassen und Patienten bereitzustellen. Untersucht werden therapeutische und diagnostische Verfahren, aber auch komplexere Gesundheitsleistungen wie beispielsweise Krebsfrüherkennungsprogramme (1). Medizinische, ökonomische, soziale, rechtliche, organisatorische sowie ethische Aspekte werden intensiv mit dem Ziel diskutiert zugehörige Entscheidungsprozesse zu unterstützen und gegebenenfalls Handlungsempfehlungen abzugeben (1–4). Durch die Darstellung der gesamten verfügbaren externen Evidenz zur Fragestellung (z. B. experimentelle Wirksamkeit – efficacy, Wirksamkeit unter Alltagsbedingungen – effectiveness, Sicherheit – safety, gesundheitsökonomischer Stellenwert – cost-effectiveness) sowie deren kritische Beurteilung und Bewertung bietet HTA eine umfassende Informationsquelle für alle Beteiligten des Gesundheitssystems. Abzugrenzen davon ist die Arzneimittelzulassung. Eine Zulassung durch die Europäische Arzneimittelbehörde (EMA) ist entscheidend für das Inverkehrbringen des Arzneimittels in allen EU-Mitgliedsländern und die Sicherstellung des Medikaments hinsichtlich pharmazeutischer Qualität, Sicherheit, Wirksamkeit und Verträglichkeit. In HTAs wird der Zusatznutzen für Patienten im klinischen Versorgungsalltag erfasst (5). Ein HTA-Bericht dient als Grundlage und Entscheidungsstütze für medizinische und gesundheitspolitische Maßnahmen und Entscheidungen (2).
Wie funktionieren HTAs auf Länderebene, zum Beispiel in Deutschland?
In Deutschland gibt es zahlreiche Organisationen mit unterschiedlichen Auftraggebern, die HTAs durchführen. Eine zentrale Rolle spielt in diesem Zusammenhang das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG), das Fragestellungen im Rahmen von HTAs koordiniert. Diese umfassen sowohl nicht-pharmazeutische als auch pharmazeutische Maßnahmen. Im nicht-pharmazeutischen Bereich wurden beispielsweise im Jahr 2022 HTA-Berichte zu den Themen partizipative Entscheidungsfindung und Apps zur Behandlung einer Angststörung vom IQWiG an externe Forschungsteams mit methodischer und klinischer Expertise in Auftrag gegeben (7). Im pharmazeutischen Bereich ist die frühe Nutzenbewertung im Sinne des Arzneimittelneuordnungs-Gesetzes (AMNOG) verpflichtend für neu zugelassene Arzneimittel im Zuge der anschließenden Preisverhandlung (1, 2). Im Gegensatz zum verpflichtenden AMNOG-Verfahren kommen die HTA-Berichte vom IQWiG durch Bürgervorschläge zustande. Diese werden lediglich an Institutionen und Akteuren mit Bezug zur GKV weitergeleitet, während die frühe Nutzenbewertung direkten Einfluss auf den GKV-Leistungskatalog hat (3, 5).
Genauso wie in Deutschland existieren auch in anderen europäischen Ländern verschiedene Stellen, die HTAs sowohl für pharmazeutische sowie nicht-pharmazeutische Fragestellungen erstellen. Beispiele dafür sind (8):
Pharmazeutischer Bereich:
Nicht-Pharmazeutischer Bereich:
HTA wird europäisch, wie kam es dazu?
Zur Effizienzsteigerung wurde in 2005 das EUnetHTA gebildet, ein Netzwerk aus 35 HTA-Institutionen. Dieses erstellte von 2010 bis 2012 eine Datenbank mit geplanten und laufenden HTA Projekten. Von den im Jahr 2015 gelisteten 1.266 Projekten wiesen 7 % identische und 16 % ähnliche Indikationen auf. Bereits dadurch zeigte sich die europaweite thematische Überschneidung bei HTA-Projekten in verschiedenen EU-Ländern (9).
Seit 2010 verfasst das EUnetHTA auf europäischer Ebene sogenannte „Relative Effectiveness Assessments“ (REA), welche den Zusatznutzen eines Medikamentes zu einer Vergleichstherapie abbilden und der nationalen Gesundheitspolitik und den nationalen Gesundheitsbehörden bei Kostenerstattungsfragen zur Verfügung stehen. Es besteht allerdings keine Verpflichtung diese auf Projektbasis erstellten HTAs in nationale Entscheidungsprozesse wie den AMNOG-Prozess miteinzubeziehen. Durch die schnelle Verfügbarkeit relevanter Informationen durch das EUnetHTA soll die zeitgerechte Erstellung nationaler HTA-Berichte und anschließender gesundheitspolitischer Beschlüsse ermöglicht werden. Hintergrund ist die gesetzliche Verpflichtung zahlreicher EU-Mitgliedsländer zur Bewertung neuer Arzneimittel innerhalb von 90 oder 180 Tagen nach einer positiven Entscheidung des Committee for Medicinal Products for Human Use der Europäischen Arzneimittelagentur. Als Grundgerüst für die REAs entwickelte das Netzwerk ein „Core Model for Rapid Relative Effectiveness for Pharmaceuticals“ (siehe Abbildung 1). Darüber hinaus existieren verschiedene Guidelines, Verfahrenshandbücher und einheitliche Berichtsvorlagen, die die Qualität der REAs sicherstellen sollen (9).

Abbildung 1: HTA-Core-Model als methodisches Grundgerüst der EUnetHTA-Gruppe zur Erarbeitung und Verteilung von HTA (10)
Welche Ziele werden mit der EU HTA-Verordnung verfolgt?
Die Europäische Kommission verfolgt mit der EU HTA-Verordnung das Ziel einer Angleichung von HTA-Instrumenten, -Verfahren und -Methoden, um eine wirksamere Ressourcennutzung und Verbesserung der HTA-Qualität im gesamten EU-Raum herbeizuführen (11). Langfristig sollen durch entsprechende Standardisierungen sowie effizientere Ansätze Markteinführungen beschleunigt werden und der Zugang neuer Technologien auf den Gesundheitsmarkt verbessert werden (12). Nachdem die auf Projektbasis entstandenen REAs von nationalen Institutionen und Behörden nur unzureichend herangezogen wurden, wurde nun mit der EU HTA-Verordnung eine verpflichtende gemeinsame HTA-Erstellung auf EU-Ebene beschlossen (11).
Neue EU HTA-Verordnung – wie geht es jetzt weiter?
Ab dem Jahr 2025 sind die EU Mitgliedsstaaten laut der EU HTA-Verordnung verpflichtet, gemeinsame HTAs zu erstellen. Dazu gelten für verschiedene Arzneimittelgruppen unterschiedliche Fristen. Für Arzneimittel mit einer onkologischen Indikation sowie Arzneimittel, die als neuartige Therapien nach der Verordnung (EG) Nr. 1294/2007 klassifiziert sind, werden ab dem 12. Januar 2025 gemeinsame europäische HTAs erstellt. Anschließend folgen ab dem 13. Januar 2028 alle Arzneimittel für seltene Leiden sowie ab dem 13. Januar 2030 alle übrigen Arzneimittel sowie Medizinprodukte der Klassen IIb oder III und In-vitro-Diagnostika der Klasse D (6) (siehe Abbildung 2). Die Koordinierungsgruppe EUnetHTA 21, bestehend aus 13 EUnetHTA-Mitgliedsorganisationen, soll über 24 Monate hinweg die methodischen Grundlagen für die gemeinsamen Bewertungen festlegen (13, 14). Dazu hat erst kürzlich ein internationales Vorbereitungstreffen mit 41 Gesandten verschiedenster internationaler HTA-Institutionen sowie zwei Vertretern der Europäischen Kommission in Köln stattgefunden (13).
Entscheidungen über den Zusatznutzen eines Medikamentes oder die Kostenerstattung von Interventionen bleiben weiterhin im nationalen Zuständigkeitsbereich. Damit können länderspezifische Versorgungsbesonderheiten sowie finanzielle Gegebenheiten der jeweiligen Gesundheitssysteme angemessen berücksichtigt werden (13, 15) .
Derzeit ist geplant, dass das EU HTA bereits während des Zulassungsprozesses durchgeführt wird, während die deutsche Nutzenbewertung weiterhin nach Markteintritt stattfindet. Für den deutschen Versorgungskontext bedeutet das, dass die Integration des EU HTA in die nationale Nutzenbewertung und Beschlussfassung Aufgabe des G-BA werden könnte (16).
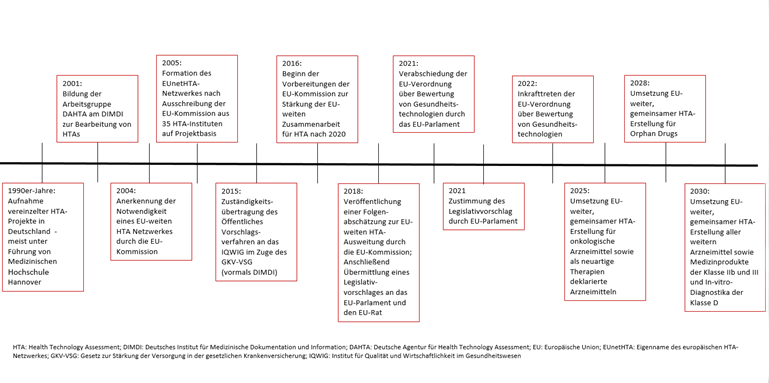
Abbildung2: Übersicht der Entwicklung von HTA in Deutschland und Europa (2, 6)
Lässt sich die EMA als Zulassungsbehörde mit EU HTAs vergleichen?
Die Arzneimittelzulassung durch die EMA zielt darauf ab, dass nur eine für alle Länder bindende Entscheidung notwendig ist. Mit EU-weiten HTAs soll keine Entscheidung herbeigeführt werden, sondern eine Zusammenfassung, Synthese und Analyse verschiedener Informationsbruchstücke erfolgen. Deren Interpretation kann von den einzelnen Mitgliedsländern für etwaige gesundheitspolitische Entscheidungen herangezogen werden (15).
Wie kann man EU-weite HTAs gestalten, um die gesetzten Ziele zu erreichen?
Ob eine verpflichtende EU-weite Ausweitung von HTAs zu der gewünschten Ressourcenersparnis führt, hängt von einer Vielzahl an Faktoren ab. Ziel dabei ist keineswegs die Zentralisierung von HTAs, sondern gemeinsame wissenschaftliche Konsultationen und klinische Beurteilungen. Dafür braucht es klare und transparente Evidenzanforderungen in den therapeutischen Indikationen, ergänzt durch einen systematischen Dialog mit allen Beteiligten, inklusive Abgleich der Anforderungen auf Zulassungs-und HTA-Ebene. Besonders in klinischen Situationen, die keine Durchführung von RCTs zulassen, ist es wichtig vorab zu definieren welche Methoden bei diesen Fällen akzeptabel sind und welche Evidenzanforderungen bei alternativen Verfahren gelten. Beispiele für alternative Anwendungsmöglichkeiten sind indirekte Vergleiche, einarmige oder sogenanntes Crossover-Studiendesigns und die Verwendung von Real-World-Data. Die Methoden und deren Akzeptanz sollten unter Beachtung aller Herausforderungen der Arzneimittelentwicklung sowie des Medizinproduktemarktes konsistent sein. Der Zeitrahmen der Erstellung der REAs sollte klar definiert sein.
Welche Auswirkungen könnte die EU-weite Ausweitung der HTAs haben?
Bei optimaler Umsetzung hat die Ausweitung unter anderem Potenzial zur Ressourceneinsparung, da die Mehrarbeit durch verschiedene HTA-Institutionen aufgrund Bearbeitung identischer Fragestellungen verhindert wird. Frei werdende Ressourcen könnten in anderen, vernachlässigten Bereichen des Gesundheitssytems eingesetzt werden. Ob das EU-weite HTA Auswirkungen auf einheitliche Evidenzanforderungen sowohl für den Zulassungsbereich als auch den HTA-Bereich haben wird bleibt fraglich. Denkbar und wünschenswert ist, dass eine Homogenisierung der zu untersuchenden und anerkannten Endpunkte über sämtliche EU-HTA-Institutionen erfolgt. Das würde für die nationalen bewertenden HTA-Institutionen eine Erleichterung darstellen, da Endpunktbewertungen nicht immer neu evaluiert werden müssten. Profitieren würden aber auch die pharmazeutischen Hersteller, da eine EU-weite Anerkennung von patientenrelevanten Endpunkten ein wichtiges Argument für die Inkludierung eines Endpunktes in die Zulassungsstudie darstellt. Durch die Formulierung EU-weiter Evidenzanforderungen in der klinischen Forschung könnte Europa daher seinen Verhandlungseinfluss im globalen Arzneimittelmarkt ausbauen.
Literatur
[1] Bundesärztekammer. Health Technology Assessment [Stand: 01.07.2022]. Verfügbar unter: https://www.bundesaerztekammer.de/themen/aerzte/qualitaetssicherung/health-technology-assessment.
[2] Deutsche Agentur für HTA am DIMDI. Der Einfluss von HTA-Berichten auf die gesundheitspolitische Entscheidungsfindung: Eine systematische Übersichtsarbeit [Stand: 01.07.2022]. Verfügbar unter: https://portal.dimdi.de/de/hta/hta_berichte/hta031_bericht_de.pdf.
[3] IQWIG – Stiftung für Qualität und Wirtschaftlichkeit im Gesundheitswesen. HTA-Berichte [Stand: 01.07.2022]. Verfügbar unter: https://www.iqwig.de/ueber-uns/methoden/ergebnisse/hta-berichte/.
[4] Cochrane Deutschland. Health Technology Assessment [Stand: 01.07.2022]. Verfügbar unter: https://www.cochrane.de/hta.
[5] IQWIG – Stiftung für Qualität und Wirtschaftlichkeit im Gesundheitswesen. Arzneimittel-Zulassung und frühe Nutzenbewertung in Deutschland [Stand: 01.07.2022]. Verfügbar unter: https://www.iqwig.de/presse/im-fokus/neue-arzneimittel-zulassung-nutzenbewertung-erstattung/1-arzneimittel-zulassung-und-fruehe-nutzenbewertung-in-deutschland/.
[6] EU Kommission. Regulation on Health Technology Assessment [Stand: 01.07.2022]. Verfügbar unter: https://health.ec.europa.eu/health-technology-assessment/regulation-health-technology-assessment_en.
[7] IQWIG – Stiftung für Qualität und Wirtschaftlichkeit im Gesundheitswesen. ThemenCheck Medizin: Das IQWiG bringt vier neue HTA-Berichte auf den Weg: Per Ausschreibung sucht das Institut jetzt externe Wissenschaftlerteams, die Antworten auf die ausgewählten Fragen recherchieren und ausarbeiten.; 2022 [Stand: 01.07.2022]. Verfügbar unter: https://www.iqwig.de/presse/pressemitteilungen/pressemitteilungen-detailseite_60864.html.
[8] EUPATI – The European Patients´ Academy. HTA-Systeme in Europa: [Stand: 01.07.2022]. Verfügbar unter: https://toolbox.eupati.eu/resources/hta-systeme-in-europa/?lang=de.
[9] Nachtnebel A, Mayer J, Erdös J, Lampe K, Kleijnen S, Schnell-Inderst P et al. HTA goes Europe: Europäische Zusammenarbeit in gemeinsamen Nutzenbewertungen und methodischen Fragen wird real. Z Evid Fortbild Qual Gesundhwes 2015; 109(4-5):291–9. Verfügbar unter: https://www.sciencedirect.com/science/article/pii/S1865921715001026.
[10] EUnetHTA. HTA Core Model® [Stand: 01.07.2022]. Verfügbar unter: https://www.eunethta.eu/hta-core-model/.
[11] EU-Kommission. ARBEITSUNTERLAGE DER KOMMISSIONSDIENSTSTELLEN – ZUSAMMENFASSUNG DER FOLGENABSCHÄTZUNG: Begleitunterlage zum Vorschlag für eine Verordnung des Europäischen Parlaments und des Ratesüber die Bewertung von Gesundheitstechnologien und zur Änderung der Richtlinie 2011/24/EU; 2018. Verfügbar unter: https://health.ec.europa.eu/system/files/2018-02/2018_ia_exefinal_de_0.pdf.
[12] Verordnung (EU) 2021/2282 des Europäischen Parlaments und des Rates vom 15. Dezember 2021 über die Bewertung von Gesundheitstechnologien und zur Änderung der Richtlinie 2011/24/EU; 2021 [Stand: 01.07.2022]. Verfügbar unter: https://eur-lex.europa.eu/legal-content/DE/TXT/?uri=CELEX:32021R2282.
[13] IQWIG – Stiftung für Qualität und Wirtschaftlichkeit im Gesundheitswesen. EU-HTA-Verordnung: Internationales Vorbereitungs-Treffen in Köln: Auf Einladung des IQWiG diskutierten 41 Gesandte europäischer HTA-Organisationen sowie zwei der EU-Kommission die nächsten Schritte auf dem Weg zur gemeinsamen Gesundheitstechnologiebewertung in der EU ab 2025. In: [Stand: 01.07.2022]. Verfügbar unter: https://www.iqwig.de/presse/pressemitteilungen/pressemitteilungen-detailseite_72000.html.
[14] EUnetHTA 21. EUnetHTA 21; 2021 [Stand: 01.07.2022]. Verfügbar unter: https://www.eunethta.eu/eunethta-21/.
[15] Kanavos P, Angelis A, Drummond M. An EU-wide approach to HTA: An irrelevant development or an opportunity not to be missed? Eur J Health Econ 2019; 20(3):329–32. Verfügbar unter: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6438931/.
[16] vfa. Die forschenden Pharma-Unternehmen. Euro-HTA – Was ist das eigentlich?; 2018 [Stand: 01.07.2022]. Verfügbar unter: https://www.vfa.de/de/wirtschaft-politik/artikel-wirtschaft-politik/euro-hta-was-ist-das-eigentlich.html.
[17] Arciero V, Delos Santos S, Koshy L, Rahmadian A, Saluja R, Everest L et al. Assessment of Food and Drug Administration- and European Medicines Agency-Approved Systemic Oncology Therapies and Clinically Meaningful Improvements in Quality of Life: A Systematic Review. JAMA network open 2021; 4(2):e2033004. Verfügbar unter: https://pubmed.ncbi.nlm.nih.gov/33570573/.
Picture: @tatomm/AdobeStock.com









